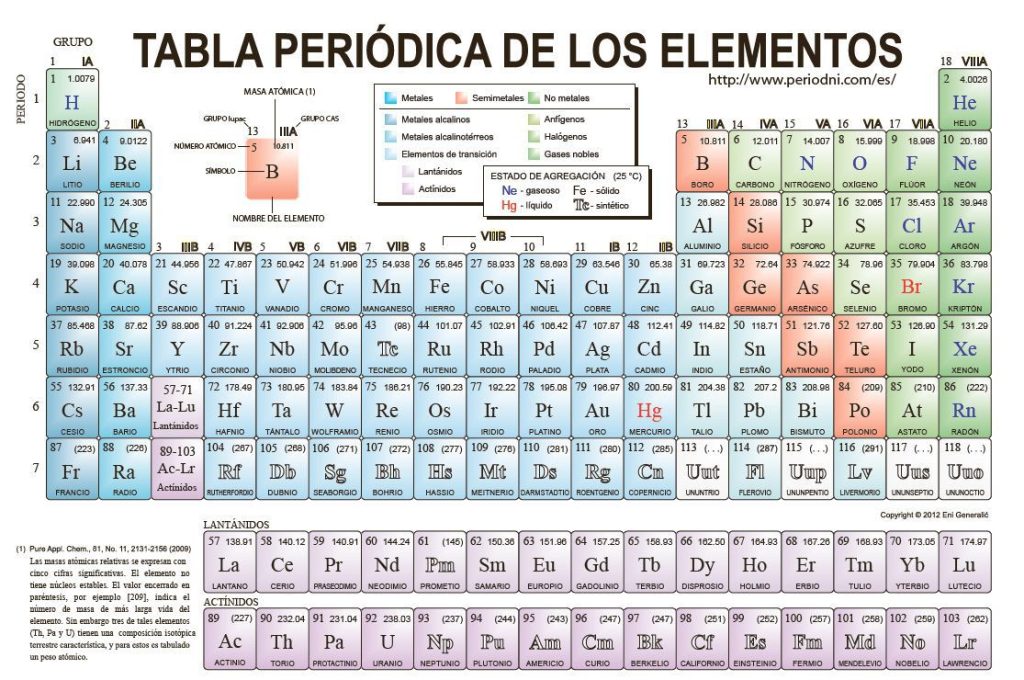
La tabla periódica es una herramienta fundamental en el estudio de la química. En ella se encuentran organizados todos los elementos químicos conocidos, permitiendo comprender su estructura, propiedades y comportamiento. Además, la tabla periódica también nos proporciona información sobre las valencias de los elementos, que son clave para entender cómo se combinan y forman compuestos químicos.
En este artículo, te brindaremos una guía completa sobre la tabla periódica y valencias de los elementos. Exploraremos su historia, su estructura y cómo utilizarla para comprender la química de una manera más profunda. ¡Prepárate para adentrarte en el fascinante mundo de los elementos químicos!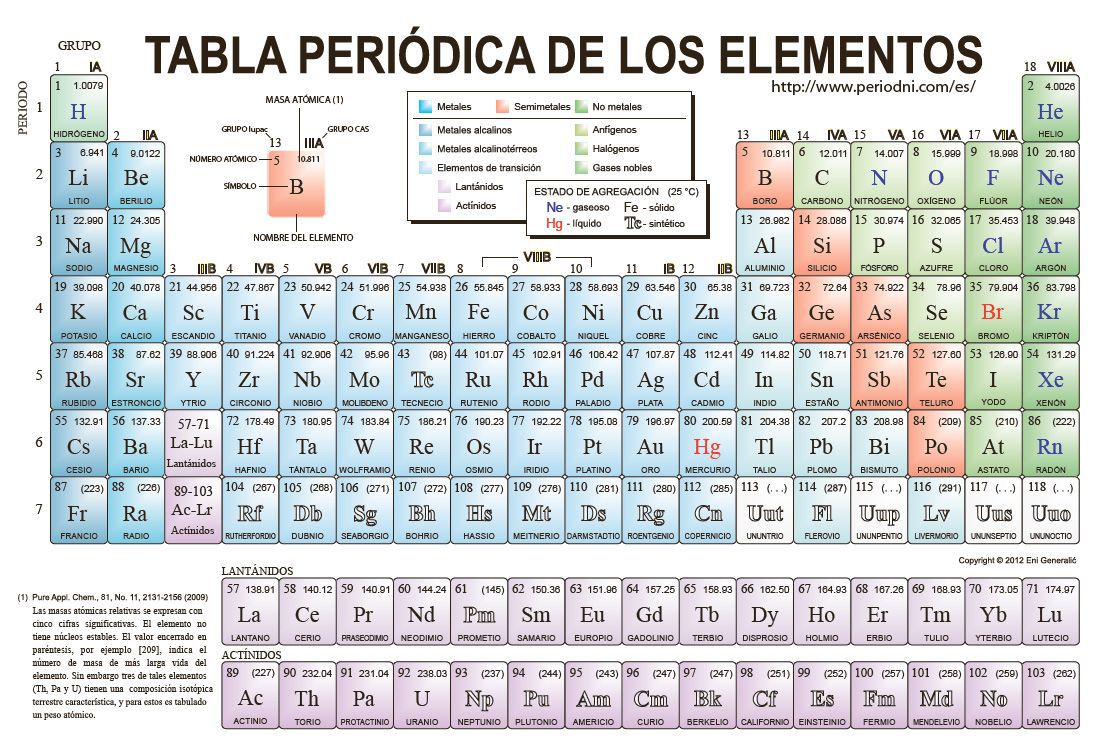
Historia de la Tabla Periódica
La tabla periódica fue desarrollada a lo largo de varios años por diferentes científicos. Uno de los primeros intentos de organizar los elementos fue realizado por el químico ruso Dmitri Mendeléyev en 1869. Mendeléyev ordenó los elementos conocidos en función de sus propiedades químicas y dejó espacios vacíos para elementos que aún no habían sido descubiertos.
A medida que se fueron descubriendo nuevos elementos y se profundizó en el estudio de sus propiedades, la tabla periódica fue evolucionando. Se agregaron nuevas filas y columnas, y se establecieron diferentes sistemas de clasificación. Actualmente, la tabla periódica moderna se basa en la estructura electrónica de los elementos y está organizada en períodos y grupos.
Estructura de la Tabla Periódica
La tabla periódica está compuesta por filas horizontales llamadas períodos y columnas verticales conocidas como grupos. Cada elemento químico se representa mediante un símbolo y se encuentra ubicado en una casilla específica de la tabla.
Los elementos están ordenados de acuerdo a su número atómico, que corresponde a la cantidad de protones en el núcleo de un átomo.
¿Qué es la Tabla Periódica?
La Tabla Periódica es una herramienta fundamental en el estudio de la química. Es una representación gráfica de todos los elementos químicos conocidos, organizados en filas y columnas según sus propiedades y características. Cada elemento está representado por un símbolo y un número atómico, que indica la cantidad de protones en su núcleo.
La Tabla Periódica se divide en grupos y periodos. Los grupos son las columnas verticales y representan elementos con propiedades similares. Por otro lado, los periodos son las filas horizontales y representan el número de capas electrónicas que tiene cada elemento.
Esta herramienta es esencial para comprender la química de los elementos, ya que nos permite identificar las valencias de cada uno. Las valencias son la capacidad de un átomo para combinarse con otros átomos y formar compuestos químicos. Con la Tabla Periódica, podemos determinar fácilmente las valencias de los elementos y predecir cómo se combinarán entre sí.
En resumen, la Tabla Periódica es una guía indispensable para entender la química de los elementos. Nos proporciona información sobre las propiedades y características de cada elemento, así como las valencias que determinan su capacidad de combinación. Con esta herramienta, podemos explorar y comprender el fascinante mundo de la química.
¿Por qué es importante conocer la Tabla Periódica?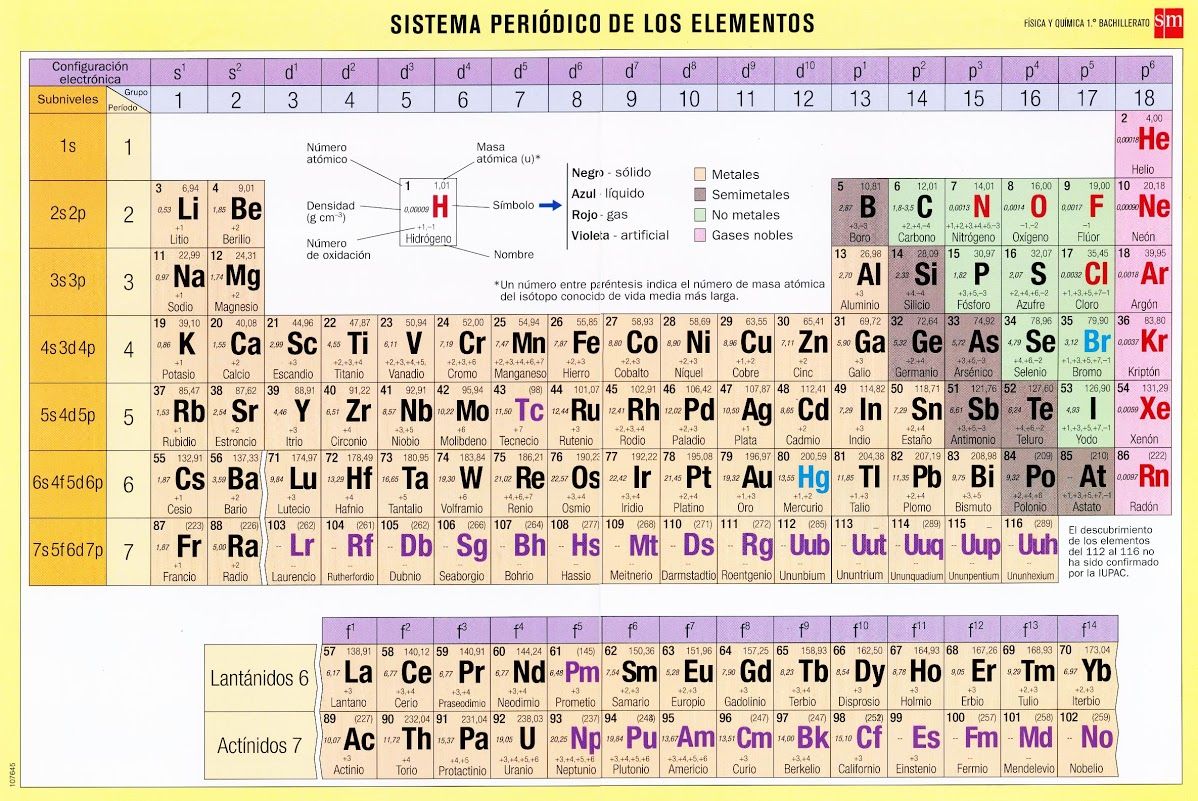
Conocer la Tabla Periódica es fundamental para comprender la química de los elementos. Esta herramienta nos proporciona información valiosa sobre las propiedades y características de cada elemento, así como su comportamiento en diferentes reacciones químicas.
La Tabla Periódica nos permite identificar y clasificar los elementos de acuerdo a su número atómico, su configuración electrónica y su posición en los grupos y periodos. Esto nos ayuda a entender cómo se relacionan los elementos entre sí y cómo se forman los compuestos químicos.
Además, conocer la Tabla Periódica nos permite predecir las valencias de los elementos, es decir, la capacidad que tienen para formar enlaces químicos. Esto es especialmente útil en la formulación de compuestos y en la comprensión de las reacciones químicas.
Historia de la Tabla Periódica
La historia de la tabla periódica se remonta al siglo XIX, cuando los científicos comenzaron a darse cuenta de que los elementos químicos podían ser organizados de manera sistemática. Uno de los primeros intentos de clasificación fue realizado por el químico alemán Johann Wolfgang Döbereiner, quien en 1829 agrupó los elementos en triadas, basándose en sus propiedades químicas similares.
Sin embargo, fue el químico ruso Dmitri Mendeléyev quien logró desarrollar la primera versión de la tabla periódica moderna en 1869. Mendeléyev organizó los elementos en función de sus masas atómicas y propiedades químicas, dejando espacios vacíos para elementos que aún no habían sido descubiertos. Su tabla periódica fue un gran avance en la comprensión de la química de los elementos y sentó las bases para las versiones posteriores.
A lo largo de los años, la tabla periódica ha ido evolucionando y mejorando. Se han descubierto nuevos elementos y se han realizado ajustes en la organización de los elementos existentes. Hoy en día, la tabla periódica es una herramienta fundamental en el estudio de la química, ya que nos permite entender las propiedades y comportamientos de los diferentes elementos y cómo interactúan entre sí.
¿Cómo se organiza la Tabla Periódica?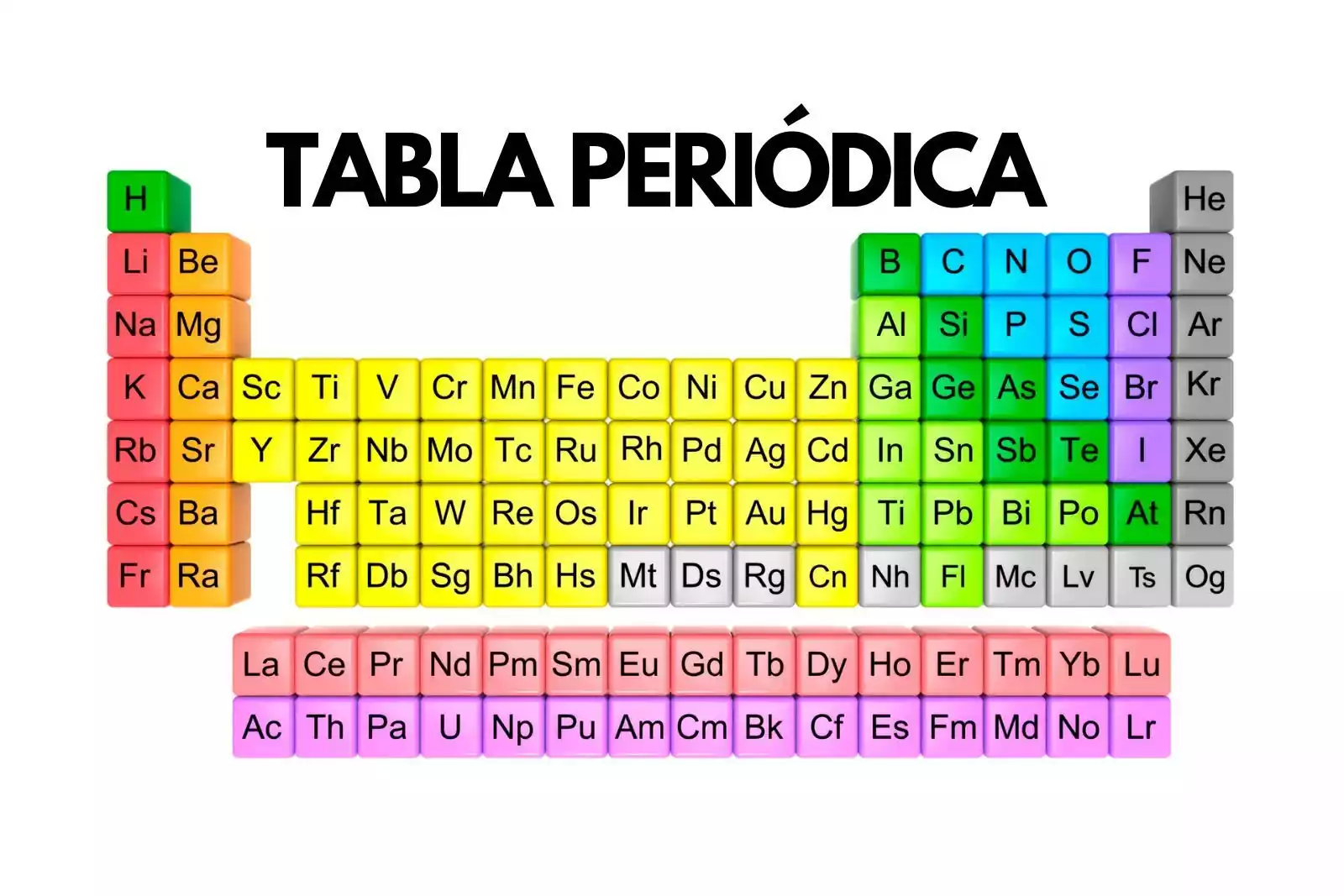
La Tabla Periódica es una herramienta fundamental en el estudio de la química, ya que nos permite comprender la estructura y las propiedades de los elementos. Esta tabla se organiza de manera sistemática, agrupando los elementos en filas llamadas periodos y columnas llamadas grupos.
En la Tabla Periódica, los elementos están ordenados de acuerdo a su número atómico, que es la cantidad de protones que tienen en su núcleo. A medida que avanzamos de izquierda a derecha en un periodo, el número atómico aumenta de manera progresiva. Por otro lado, a medida que descendemos en un grupo, los elementos tienen propiedades químicas y físicas similares.
La Tabla Periódica también se divide en bloques, que corresponden a las diferentes capas electrónicas de los átomos. Estos bloques son: s, p, d y f. Los elementos del bloque s se encuentran en los grupos 1 y 2, los del bloque p en los grupos 13 al 18, los del bloque d en los grupos de transición y los del bloque f en los lantánidos y actínidos.
En resumen, la Tabla Periódica se organiza de manera sistemática, agrupando los elementos en periodos y grupos de acuerdo a su número atómico. Además, se divide en bloques que corresponden a las diferentes capas electrónicas de los átomos. Esta organización nos permite comprender la estructura y las propiedades de los elementos químicos.
Grupos y Periodos en la Tabla Periódica
La tabla periódica es una herramienta fundamental en el estudio de la química, ya que nos permite comprender la organización y las propiedades de los elementos. Para entenderla mejor, es importante conocer los conceptos de grupos y periodos.
Los grupos son las columnas verticales de la tabla periódica, y están numerados del 1 al 18. Cada grupo tiene características similares debido a que los elementos que lo conforman tienen la misma cantidad de electrones en su capa de valencia. Por ejemplo, el grupo 1, también conocido como los metales alcalinos, tiene un solo electrón en su capa de valencia, lo que les confiere propiedades reactivas y una tendencia a formar iones positivos.
Por otro lado, los periodos son las filas horizontales de la tabla periódica. Cada periodo representa un nivel de energía en el que se encuentran los electrones de los elementos. A medida que avanzamos de izquierda a derecha en un periodo, la cantidad de electrones en la capa de valencia aumenta, lo que influye en las propiedades químicas de los elementos. Por ejemplo, los elementos del periodo 2 tienen dos electrones en su capa de valencia, mientras que los del periodo 3 tienen tres.